Jedna od najvećih misterija u neuronauci je sigurno uzrok Hantingtonove bolesti. A sada smo jako blizu rešavanju ove misterije. Naime, naučnici su otkrili strukturu proteina koji izaziva Hantingtonovu bolest. Ovo otkriće donosi nadu za tretman koji bi mogao zaustaviti bolest u svojim stazama, ali to nije sve. Pošto su slični proteini uključeni u druge neurodegenerativne bolesti, poput Alchajmerove bolesti, ovaj rezultat bi mogao imati revolucionarne implikacije i za njih.
Protein o kome je reč naziva se huntingtin (HTT). U Hantingtonovoj bolesti, genetska mutacija uzrokuje da HTT protein razvije abnormalno dugačak niz ponavljajućih aminokiselina unutar svoje strukture, nazvan poliglutamin (poliK). Obično postoji u proseku 17-20 ponavljanja ove sekvence. U Hantingtonu ih često ima 40 ili više. Što se više ponavlja, ranije počinju da se pojavljuju simptomi bolesti, poput promena ličnosti i poremećaja kretanja.
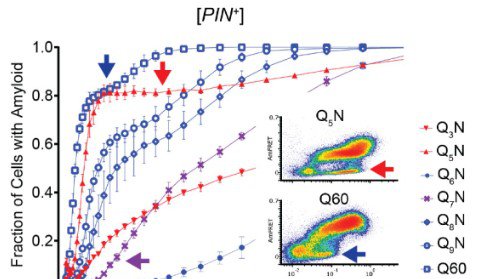
Foto: elife/Skrinšot
Mutantni oblik proteina se nakuplja u mozgu i savija se u oblik koji je toksičan za ćelije. Proteini koji se ponašaju na ovaj način nazivaju se amiloidi i uključeni su u niz drugih poremećaja. U mozgu postoje Alchajmerova bolest i Parkinsonova bolest, od kojih su obe povezane sa klasterima abnormalnog beta-amiloidnog proteina. Kada različiti prekursori amiloida počnu da se nakupljaju u ostatku tela, to može dovesti do različitih patologija koje se zajednički nazivaju amiloidoza.
Naučnici su znali da se to dešava, ali nisu razumeli kako. To je razrešio tim Stovers instituta za medicinska istraživanja.
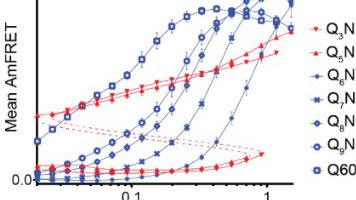
Foto: elife/Skrinšot
- Tri decenije znamo da se Hantingtonova i srodne smrtonosne bolesti javljaju kada proteini sadrže više od oko 36 Q u vrsti, što ih uzrokuje da formiraju lance proteina u mozgu, ali nismo znali zašto. Jedna od velikih misterija Hantingtonove, Alchajmerove i ALS-a je zašto se bolest poklapa sa amiloidom, ali sami amiloidi nisu glavni krivci - rekao je stariji autor dr Randal Halfmann u izjavi.
Istraživački tim, koji su predvodili prvi autori dr Tej Kandola i Šriram Venkatesan, utvrdio je strukturu amiloidnog jezgra za HTT protein, "iskru" koja pokreće lančanu reakciju pogrešnog savijanja proteina.
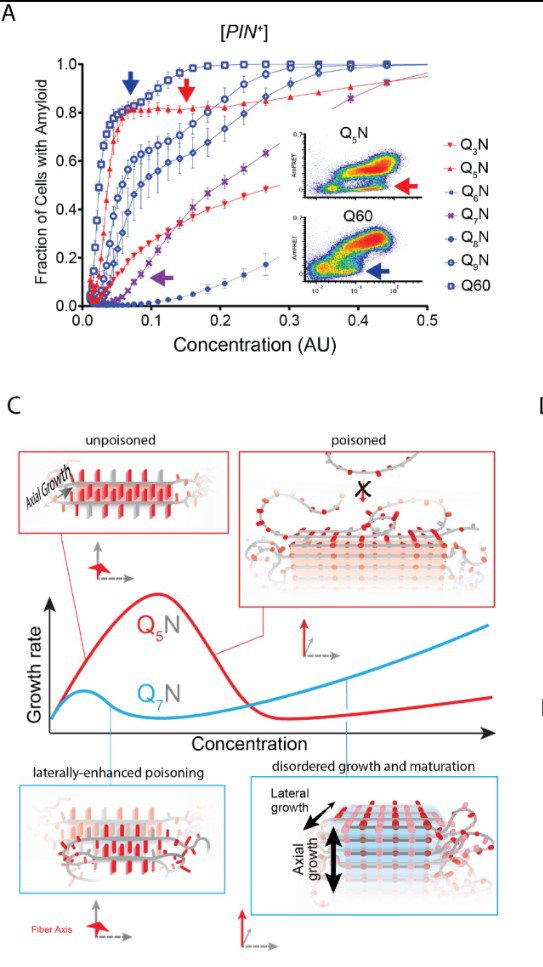
Foto: elife/Skrinšot
- Ovo je prvi put da je neko eksperimentalno odredio strukturu amiloidnog jezgra iako je većina glavnih neurodegenerativnih bolesti povezana sa amiloidima - rekao je Halfman.
Jedan od ključeva ovog otkrića je da se jezgro formira samo u izolovanim proteinima. Pronalaženje načina da se proteini spoje zajedno moglo bi zaustaviti stvaranje amiloida, potencijalno revolucionirajući tretman ove razorne bolesti.
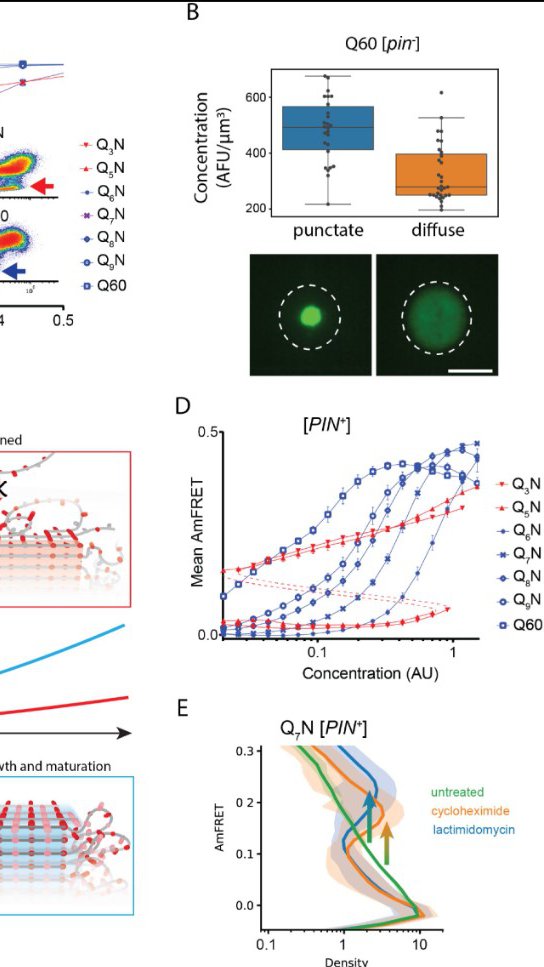
Foto: elife/Skrinšot
Tokom svojih eksperimenata, tim se okrenuo novoj tehnici, upravo razvijenoj u Halfmannovoj laboratoriji, nazvanoj Distributed Amphifluoric Forster Resonance Energi Transfer (DAmFRET). Omogućava naučnicima da posmatraju kako se proteini sami sastavljaju unutar pojedinačnih ćelija, omogućavajući im da podese sekvencu proteina da vide kakve efekte to ima. Tim je koristio ovu tehniku da pokuša da odredi minimalni broj poliQ ponavljanja potrebnih da bi HTT počeo da formira amiloidne snopove unutar jedne ćelije, što se naziva nukleacija.
- Sada imamo jake dokaze da je 36 Q kritičan broj za nukleaciju u pojedinačnim proteinskim molekulima, i štaviše, da se to tako dešava unutar živih ćelija - objasnio je Halfman.
Tim se nada da će budući rad moći da istraži načine za sprečavanje nukleacije tako da se pogrešno savijanje proteina nikada ne pokrene. Kako je Halfman rekao: „Sada smo shvatili kako izgleda prva karika u lancu i, čineći to, otkrili smo novi način da je zaustavimo". Studija je objavljena u eLife-u.
IZVOR: YT / Stowers Institute for Medical Research

Ovaj restoran služi čorbu sa celom žabom 🐸

Najmanji i najjeftiniji električni kamion na svetu 🚚
Autor: redportal.rs